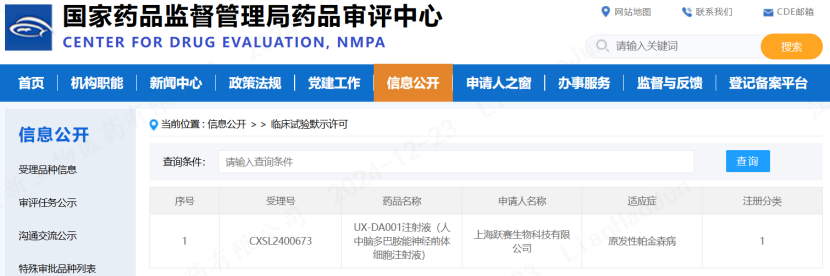
2024年12月20日,上海跃赛生物科技有限公司(以下简称“跃赛生物”)所提交的针对帕金森病的iPSC来源细胞药物产品UX-DA001注射液(人中脑多巴胺能神经前体细胞注射液)获得中国国家药品监督管理局药品审评中心(CDE)的临床试验默示许可(受理号:CXSL2400673),成功进入临床试验阶段。这是国内首款、全球第二款IND申报获批临床试验默示许可的针对帕金森病的自体iPS衍生细胞治疗药物。
UX-DA001注射液
获得CDE默示许可

苏州市吴中大道1463号越旺智慧谷4号楼