2024年5月,江苏谱新生物医药有限公司(以下简称“谱新生物”)成功获得了来自欧盟质量受权人 (Qualified Person,QP) 的欧盟QP符合性声明。这份声明涵盖了质粒、慢病毒、细胞药物生产,细胞库/菌种库建库与存储,理化、微生物、生化分析检测,先进疗法医学产品(ATMPs)的存储和发运等细胞药物全流程。欧盟QP符合性声明:欧盟及PIC/S成员国在产品临床阶段的一种正式的GMP符合性声明,具有法律认可的效力,在临床阶段其效力等同于官方的检查。QP需对企业的GMP执行结果承担相应的责任。在临床阶段,这一声明可作为GMP符合性资料递交至欧盟或PIC/S国家,作为GMP符合性的有力依据。
继获得全国首张细胞药物全流程受托生产《药品生产许可证》后,谱新生物再次创造了新的里程碑——获得全国首张细胞药物全流程受托生产欧盟QP符合性声明。这一成就标志着,谱新生物将细胞药物这种“在岸生产”的“活的”药物,已经符合了NMPA(中国药品监督管理局)、EMA(欧洲药品管理局)和FDA(美国食品药品监督管理局)的严格标准,实现了跨境交付。结合先进的细胞药物进出口平台和位于比利时的欧洲基地,谱新生物成功构建了以NK、γδT、UCAR-T、NKT等为代表的通用型细胞药物单中心生产支持全球多中心临床的供应体系。这一体系的建立不仅优化了生产流程,还提高了供应效率,更为通用型细胞药物提供了高效的生产和供应支持。QP审计官对谱新生物进行了为期五天的现场审计,审计范围涵盖了从质粒、慢病毒的生产到细胞药物的制造、检测、放行及最终发运的全流程。审计过程严格遵循了欧盟药事法规集合第4卷——药品GMP(EudraLex Volume 4)(包括EU GMP Part I, II, III及其附录1、2、15)、国际人用药注册技术协调理事会(ICH)以及MHRA数据完整性指南等法律法规。审计范围覆盖了质量体系、公用系统、生产管理体系、仓储物流体系、检测和放行以及生物安全管理等多个方面。谱新生物在细胞生产过程管理方面的污染控制策略(CCS)得到了QP审计官的高度认可。审计官表示,谱新生物不仅拥有高标准的质量管理体系和先进的设施设备,而且其团队经验丰富,完全符合欧盟GMP的监管要求。
作为细胞药物CDMO龙头企业,谱新生物本次获得的细胞药物全流程的欧盟QP符合性声明,结合其已持有的NMPA的细胞药物受托生产的《药品生产许可证》以及FDA的DMF备案,将为其境内外合作伙伴的细胞药物在欧盟及PIC/S 成员国赢得了更大的优先权及更广泛的影响力。这不仅将大大缩短监管审查时间,还将全面支持细胞药物跨境技术转移和CAR-NK、γδT、UCAR-T等通用型细胞药物的全球供应。这一成果对于谱新生物而言,无疑是其作为行业龙头企业地位的再次巩固和提升。谱新生物副总经理徐贤斌表示:质量高标准和交付高效率,是谱新生物服务客户的基石。此次成功通过欧盟QP审计,是谱新生物国际化战略迈出的重要步伐,必将助力更多细胞药物客户实现全球布局。我们将持续努力,致力于推动细胞药物在安全、有效、质量可控的基础上,实现全球范围内的产业化发展。我们期望通过不懈努力,将更多中国优质的细胞药物推向世界舞台,让全球最好的细胞药物惠及中国患者,让细胞药物谱新生命新篇章。相关产品服务信息及购买信息
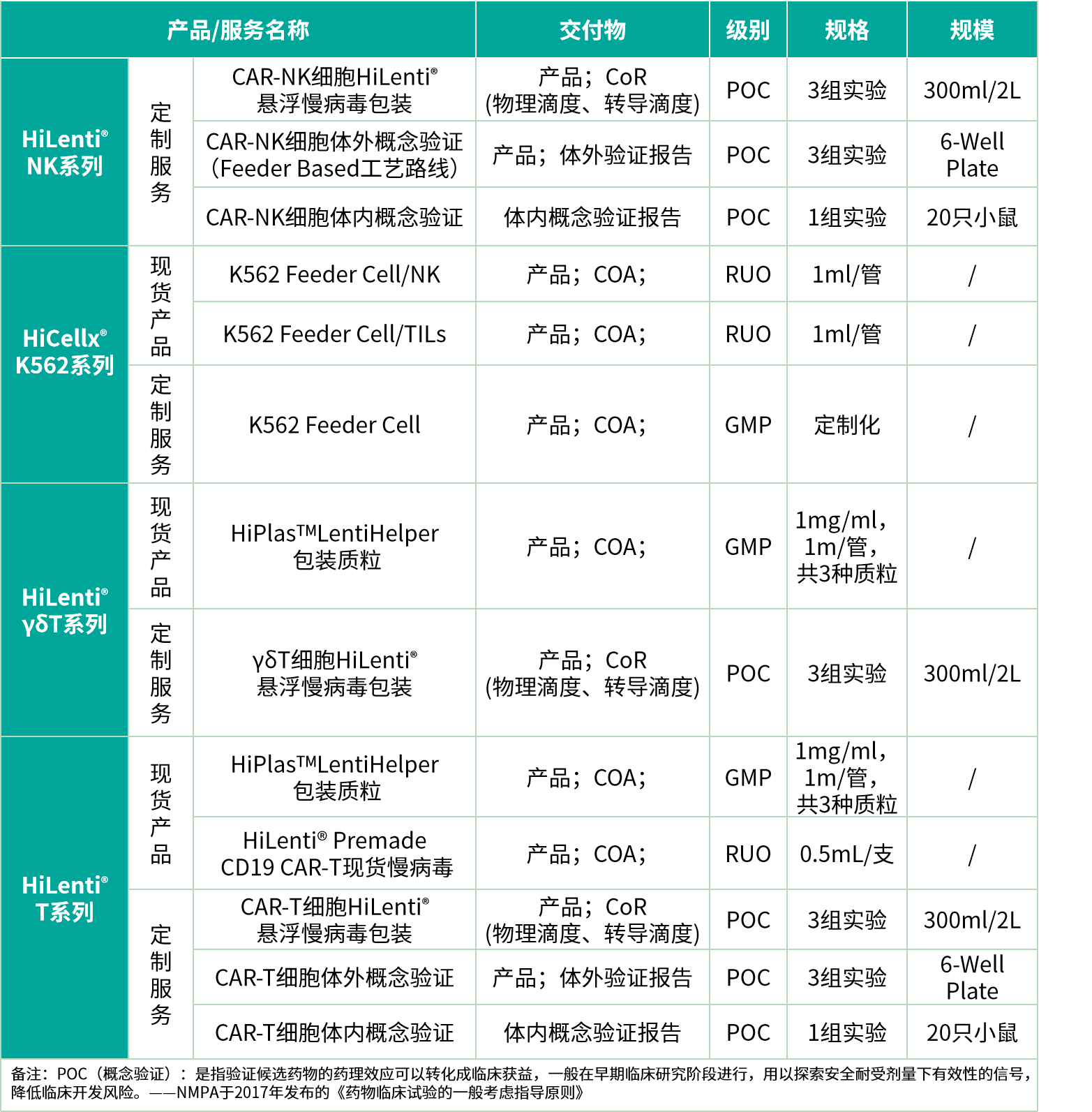
如果您对我们的产品及服务有订购需求或需要进一步的帮助,请扫描如下二维码,选择产品并填写您的信息。



