质粒作为 TCR-T 细胞药物生产的关键步骤之一,涉及复杂的生产、纯化、分析等过程。细菌质粒作为目前基因工程领域的基础工具,既可作为基因细胞治疗终产品,也可作为基因细胞治疗生产的中间载体,是绝大部分基因细胞治疗生产过程必不可少的一环。 随着细胞治疗行业的兴起,市场对质粒的需求也逐年增长。谱新生物专注于细胞治疗药物CDMO 服务的整体解决方案,搭建了GMP级别核酸类产品工艺开发平台,可以为不同的客户提供高品质的质粒 CDMO 服务。
服务内容
质粒CDMO服务 | ||||
类别 | 服务内容 | |||
IND级别 | 1 | 自研四质粒载体系统 | ● 三代四质粒载体系统 ● 卡那抗性 ● 可授权 | ● 中美双报标准 ● Full-GMP车间 ● 单独建库区域 ● 带菌区和无菌区单独车间 ● GMP质量管理体系 |
2 | GMP菌种库建立 | ● 单克隆筛选 ● 可定制化建库数量 ● 库稳定性研究 | ||
3 | 工艺与检验方法开发 | ● 根据项目要求(可定制) | ||
4 | GMP质粒生产 | ● 产量:10mg~1g(可定制) ● 发酵规模:3~30L(可定制) ● 纯化方法:三步法/两步法 | ||
5 | 质粒检验 | ● 纯度(HPLC) ● E.coli DNA残留检测 ● E.coli HCP残留检测 ● E.coli RNA残留检测 ● 抗生素残留检测 ● 无菌 ● 支原体 ● 内毒素 | ||
6 | 方法学验证 | ● 专属性 ● 准确度 ● 精密度 ● 样品稀释线性及范围 ● LOD等 | ||
7 | 稳定性研究 | ● 长期稳定性 ● 加速稳定性 ● 影响因素 | ||
服务优势
质粒载体系统优势: • 自研四质粒卡那抗性载体系统 • 载体优化能力具有可持续性 • 质粒序列可追溯、合规、高效 • 丰富的有成功IND 申报经验 • 注册临床TCR-T 细胞样品生产使用中 • 经过多个项目的对比,客户项目更改为我司载体系统 后均有2-5 倍的滴度提高 | 质粒生产优势: • 全生产流程坚持无抗生素添加 •质粒生产建库为单独车间区域 •带菌区和无菌区完全隔离 •终产品使用隔离器进行分装 •包装质粒(慢病毒用)已经完成CTD资料撰写,可缩短申报时间3-4个月,并有多个项目获得默示许可,并正在进行注册临床I期 |
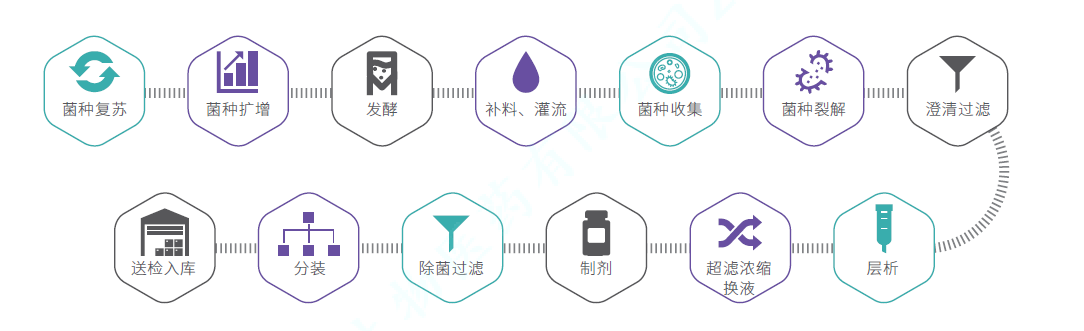
生产流程
质量控制
检测项目 | 检测方法 | |
外观 | 目视法 | |
鉴别 | 鉴别1 | 限制性内切酶法 |
鉴别2 | 桑格测序(Sanger) | |
检查 | pH | 2020版ChP 0631 |
纯度 | 高效液相色谱法(HPLC) | |
E.coli宿主蛋白残留 | 酶联免疫法 | |
E.coli DNA残留 | q-PCR法 | |
E.coli RNA残留 | q-PCR法 | |
抗生素残留 | 酶联免疫法 | |
细菌内毒素 | 2020版ChP 1143 | |
无菌 | 2020版ChP 1101 | |
浓度测定 | DNA浓度 | 2020版 ChP 0401 |
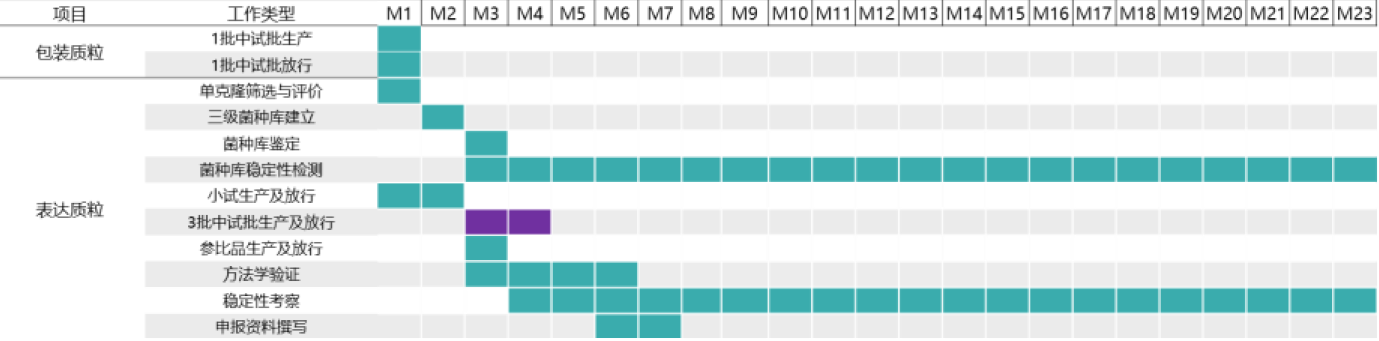
项目周期
项目管理方案
谱新生物的项目管理团队为每一个GMP项目保驾护航,团队组成包括项目首席科学家、项目经理、项目QA和GMP实施技术专家。

咨询热线:400-900-1882
检测咨询:test@hillgene.com
CDMO服务:bd@hillgene.com
产品咨询:info@hillgene.com
地址:苏州市吴中区吴中大道1463号越旺智慧谷A4号楼整幢

苏州市吴中大道1463号越旺智慧谷4号楼